
此次獲批為石藥在細胞治療領域的重要成果。據悉,目前在全球范圍尚無CAR-T療法獲批用于治療系統(tǒng)性紅斑狼瘡。SYS6020細胞注射液針對BCMA抗原,有望為SLE患者提供新的治療選擇,且成本較低。
特異性識別BCMA抗原,安全性、有效性良好
SYS6020為一款基于mRNA-LNP的嵌合抗原受體(CAR)-T細胞注射液,也是全球首款獲批臨床試驗的基于mRNA-LNP的CAR-T細胞治療候選藥物。
該產品通過表達可特異性識別BCMA抗原的CAR,與成熟B淋巴細胞和漿細胞表面的BCMA結合,靶向殺傷免疫細胞,消除升高的自身抗體,從而達到治療目的,是SLE患者一種全新的、安全有效的潛在治療選擇。
與傳統(tǒng)的CAR-T產品相比,SYS6020具有細胞活率高、CAR陽性率高、無基因組整合引起的致瘤風險,以及細胞因子風暴(CRS)等副作用低的優(yōu)點。
臨床前研究顯示,該產品可顯著殺傷BCMA抗原陽性的骨髓瘤細胞,并具有良好的安全性。在成本方面,使用LNP轉染T細胞,可以降低使用慢病毒載體的高昂成本,減輕患者的負擔。
SYS6020也是石藥集團布局的首個細胞治療在研產品。在此前的今年6月底,SYS6020細胞注射液在中國首次獲批臨床,擬開發(fā)治療復發(fā)或難治性多發(fā)性骨髓瘤(MM)。臨床前研究顯示,它可顯著殺傷BCMA抗原陽性的骨髓瘤細胞,并具有良好安全性和有效性。彼時,石藥集團公告指出,除了多發(fā)性骨髓瘤適應癥,SYS6020還潛在可用于治療系統(tǒng)性紅斑狼瘡、重癥肌無力等自身免疫性疾病。
此次SLE適應癥臨床試驗的獲批,是石藥集團在細胞治療領域布局的又一重要成果,為其他細胞治療產品,如體內生成CAR-T的開發(fā)奠定了良好基礎。
傳統(tǒng)療法副作用強,CAR-T療法實現(xiàn)精準打擊
系統(tǒng)性紅斑狼瘡(SLE)是機體免疫系統(tǒng)攻擊自身組織導致的一種復雜的慢性系統(tǒng)性自身免疫性疾病,發(fā)病機制復雜。根據《中國狼瘡性腎炎診斷和治療指南》,我國系統(tǒng)性紅斑狼瘡人群發(fā)病率為30.13-70.41/10萬人,對應患者人數達到42.2萬至98.6萬人。
此病難以根治,需要長期服藥,但傳統(tǒng)治療方式易產生副作用。中國系統(tǒng)性紅斑狼瘡研究協(xié)作組(CSTAR)的數據顯示,我國84.13%的SLE患者正在使用激素治療,其中部分患者用于維持治療的激素劑量偏大,不良反應也隨著劑量增加而增多。
生物制劑是近年來改變SLE治療理念的新興療法,通過干預免疫系統(tǒng)的信號傳導途徑,抑制異常的免疫反應,降低免疫系統(tǒng)對自身組織的攻擊,同時通過調節(jié)特定的免疫細胞,如T細胞和B細胞,以減少它們對身體組織的攻擊。生物制劑降低了系統(tǒng)性紅斑狼瘡患者對激素的依賴,但目前全球獲批上市的僅有3款藥物,分別是貝利尤單抗,泰它西普和Anifrolumab。
近年來,CAR-T細胞療法在難治性系統(tǒng)性紅斑狼瘡中展現(xiàn)出了驚人的療效,為這片黑暗領域帶來了一線曙光。
相比傳統(tǒng)治療方式,CAR-T治療有著獨特的優(yōu)勢。首先,基于SLE的重要發(fā)病機制之一是B細胞的“叛變”,將自身組成成分識別為“外敵”,從而啟動免疫反應,產生針對自身組織的抗體,造成多器官損害。因此,清除體內“叛變”的B細胞以及其產生的抗體是系統(tǒng)性紅斑狼瘡治療的一大方向。CAR-T通過將T細胞進行體外改造,帶上能特異性識別“叛變”B細胞的蛋白,而后將改造后的T細胞進行回輸,清除“叛變”的B細胞,可以實現(xiàn)精準攻擊。相較于傳統(tǒng)治療的無差別攻擊,CAR-T治療的精準攻擊是最大的優(yōu)勢。
其次,CAR-T治療重建后的B細胞分泌的抗體類型與治療前大不相同,這表明自身免疫B細胞的清除起到了更廣泛的免疫重塑作用。此外,生物制劑需要反復輸注,來實現(xiàn)相關信號通路的持續(xù)阻斷,而CAR-T治療只需要單次輸注就可以持續(xù)深度地清除靶向B細胞。這也是傳統(tǒng)治療以及生物制劑無法實現(xiàn)的。
不僅如此,紅斑狼瘡比B細胞腫瘤更容易成為CAR-T細胞治療的靶點,在B細胞腫瘤治療中,由于腫瘤抗原的異質性,需要制備裝配不同類型的CAR-T,靶向不同抗原,因此腫瘤CAR-T靶點的選擇是其應用過程中的重點和難點。
目前在SLE 治療中,臨床研究多數是設計成靶向CD19 CAR-T,通過結合基于T細胞的療法和治療前的淋巴耗盡方案,可以成功清除功能失調的B細胞并重建免疫系統(tǒng),從而使SLE得到有效控制。
在劑量和副作用方面,細胞因子釋放綜合征(CRS)和免疫效應細胞相關神經毒性綜合征(ICANS)是CAR-T治療的常見副作用。由于SLE患者體內靶向的B細胞數量明顯低于腫瘤患者,因而CAR-T療法所引發(fā)CRS的風險將更小。另一方面,較低的B細胞數量減少了需要輸注的CAR-T細胞數量,進而限制了不必要的CAR-T細胞毒性,減少免疫效應細胞相關神經毒性綜合征的發(fā)生。
因此,相較于腫瘤患者,由于靶向細胞的比例較小,SLE患者接受CAR-T治療將有著更好的安全性。但仍需要更大樣本的研究和更長時間的隨訪來證實其長期的安全性。
國內外多家藥企布局,管線多處于臨床早期
CAR-T療法為治療系統(tǒng)性紅斑狼瘡提供了新的方向,但CAR-T療法遲遲未走向SLE治療的臨床應用?究其原因,CAR-T療法對于患者的長期療效和安全性還需要進一步研究,該療法的可行性也還需進一步驗證。
目前,CAR-T治療僅限于小樣本的臨床研究,要真正實現(xiàn)臨床應用,需要更大樣本的臨床研究證實CAR-T治療的有效性和安全性。同時,雖然在理論上CAR-T治療會精準清除B細胞,并重建B細胞的功能,能有效控制SLE的活動,但是其長期有效性尚無相關數據。
另外,雖然目前的小樣本臨床研究證實CAR-T細胞治療自身免疫性疾病的總體安全性非常好,部分患者僅表現(xiàn)為輕度細胞因子釋放綜合征(CRS),但長期的安全性需要更長時間的隨訪和證實。經過CAR-T治療的SLE患者在長期隨訪中是否會增加相關腫瘤和感染發(fā)生的風險?總體的預期壽命是否能夠延長?這些都尚未可知。
目前,國內外多家細胞治療公司均已積極布局CAR-T藥物用于治療系統(tǒng)性紅斑狼瘡等自免疾病的研發(fā)管線,包括藥明巨諾的瑞基奧侖賽注射液、亙喜生物的CD19/BCMA 雙靶CAR-T等。
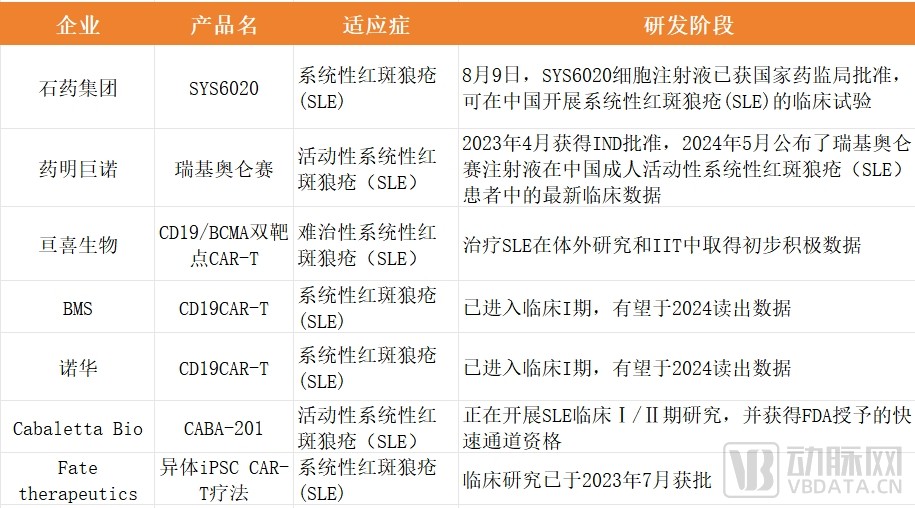 國內外在布局治療SLE等自免疾病的CAR-T研發(fā)管線情況(不完全統(tǒng)計)
國內外在布局治療SLE等自免疾病的CAR-T研發(fā)管線情況(不完全統(tǒng)計)
據不完全統(tǒng)計,目前全球7款在研的治療SLE適應癥的CAR-T藥物管線中,有3款已經進入臨床試驗階段,進度較快的為Cabaletta Bio的CABA-201,正在開展SLE臨床Ⅰ/Ⅱ期研究,并獲得FDA授予的快速通道資格。
其中,中國正在開發(fā)治療SLE的CAR-T產品管線已有不少,但絕大多數尚處于由研究者發(fā)起的臨床研究(IIT)中,邁入注冊性臨床開發(fā)階段的管線數量仍然屈指可數。
未來,CAR-T治療紅斑狼瘡是否能夠成功,還需要更多的臨床數據說話,期待這些臨床試驗取得好的結果,推動CAR-T成為SLE患者更安全、更有效、真正臨床可用的療法。
轉載來源:動脈網 作者:車維維

 京公網安備 11010802028547號
京公網安備 11010802028547號